Умягчение воды при водоподготовке. Методы устранения жёсткости воды
ЖЕСТКОСТЬ ВОДЫ
ЦЕЛЬ РАБОТЫ
Ознакомиться с методами определения карбонатной и общей жесткости воды, а также с методикой умягчения водопроводной воды.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Одним из технологических показателей, принятым для характеристики состава и качества природных вод, является жесткость воды . Жесткостью воды принято называть свойство воды, которое характеризуется содержанием в ней солей кальция и магния. Суммарное содержание растворимых солей кальция и магния определяет общую жесткость воды : Ж ОБЩ = + , складывающейся из кальциевой и магниевой жесткости, обусловленной соответственно катионами кальция Ca 2+ и магния Mg 2+ .
В зависимости от природы анионов принято различать карбонатную Ж К и некарбонатную Ж НК жесткость , сумма которых определяет общую жесткость воды:
Ж ОБЩ = Ж К + Ж НК. (1)
Карбонатная жесткость характеризуется присутствием в воде растворимых гидрокарбонатов кальция Ca(HCO 3) 2 и магния Mg(HCO 3) 2 . Она обусловлена растворением в природной воде диоксида углерода CO 2 и образованием раствора угольной кислоты:
СО 2 + Н 2 О ↔ Н 2 СО 3 , (2) которая, диссоциируя, образует гидрокарбонат-ионы НСО 3 ¯ :
Н 2 СО 3 ↔ Н + + НСО 3 ¯ , (3) связываемые затем ионами кальция и магния с образованием соответствующих гидрокарбонатов:
Са 2+ + НСО 3 ¯ ↔ Ca(HCO 3) 2 , (4)
Mg 2+ + НСО 3 ¯ ↔ Mg(HCO 3) 2 . (4а)
При длительном кипячении воды с карбонатной жесткостью появляется осадок (CaCO 3 и MgCO 3) вследствие разложения солей:
Ca(HCO 3) 2 = CaCO 3 ↓+ Н 2 О + СО 2 , (5)
Mg(HCO 3) 2 = MgCO 3 ↓ + Н 2 О + СО 2 . (5а)
Поэтому карбонатную жесткость называют также временной или устранимой жесткостью .
Некарбонатная жесткость обусловлена присутствием в воде солей сильных кислот – сульфатов или хлоридов кальция и магния (MgSO 4 , MgCl 2 , CaCl 2 и др.), которые при кипячении не удаляются. Поэтому некарбонатную жесткость принято называть также постоянной жесткостью.
Жесткость воды выражается суммой миллимолей эквивалентов ионов кальция и магния, содержащихся в одном литре воды. Один миллимоль эквивалентов жесткости отвечает содержанию 20,04 мг/л катионов Ca 2+ или 12,16 мг/л катионов Mg 2+ .
Жесткость природных вод изменяется в широких пределах. В разных водоемах она различна, а в одной и той же реке меняется в течение года (минимальна во время паводка). Жесткость вод морей изначально выше, чем рек и озер. Так, вода Черного моря имеет общую жесткость 65,5 ммоль экв/л. Среднее значение жесткости воды мирового океана 130,5 ммоль экв/л (в том числе на Ca 2+ приходится 25,5 ммоль экв/л, на Mg 2+ – 108 ммоль экв/л).
В зависимости от величины жесткости воду делят на 5 классов: очень мягкую - 0 – 1 ммоль экв/л; мягкую - 1 – 3 ммоль экв/л; умеренно жесткую - 3 – 6 ммоль эвк/л; жесткую - 6 – 10 ммоль эвк/л и очень жесткую - > 10 ммоль экв/л.
Использование жесткой воды для удовлетворения хозяйственно-бытовых и производственных целей нежелательно. Так, при нагревании и особенно, при испарении воды эти соли образуют слой накипи, снижающий коэффициенты теплопередачи в охлаждающих и нагревающих системах, что является крайне нежелательным.
Необходимость удаления солей, определяющих жесткость, можно проиллюстрировать следующим примером. Прямоточный паровой котел производит 500 тонн водяного пара в час и использует воду с карбонатной жесткостью 1 ммоль экв/л. В 500 м 3 воды содержится 500 эквивалентов Сa(НCO 3) 2 или 500·56 = 28000 г или 28 кг гидрокарбоната кальция. При полном его разложении на стенках котла за один час работы осядет карбонат кальция в виде накипи в количестве кг. Таким образом, прямоточный котел, состоящий из системы испарительных трубок, в течение суток выйдет из строя.
АНАЛИЗ КАЧЕСТВА ВОДЫ
1. Общая жесткость воды Ж ОБЩ определяется методом комплексонометрии. Метод основан на титровании воды раствором комплексона III в присутствии аммиачного буферного раствора (pH=10,0) и индикатора до перехода исходной розовой окраски в голубую. В качестве индикатора могут служить кислотный хром синий К или эриохром черный Т. Эти индикаторы окрашиваются в розовый цвет при наличии в воде ионов жесткости Ca 2+ и Mg 2+ , а в их отсутствии – в голубой.
Комплексон III (другие названия: EDTA, трилон Б) представляет собой двузамещенную натриевую соль этилендиаминтетрауксусной кислоты:
NaOOCH 2 С CH 2 COONa
Н 2 N – CH 2 – CH 2 – NН 2
HOOCH 2 С CH 2 COOH
При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение, в котором ион кальция Ca 2+ (или Mg 2+) выступает в роли комплексообразователя:
OOCH 2 С CH 2 COO
Н 2 N – CH 2 – CH 2 – NН 2
OOCH 2 С CH 2 COO
Связывание ионов кальция и магния комплексоном приводит к изменению окраски индикатора в оттитрованном растворе до голубого цвета.
2. Карбонатная жесткость воды Ж К определяется методом нейтрализации. Он основан на титровании воды, в которую добавляется метиловый оранжевый, раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую. Метиловый оранжевый является кислотно-основным индикатором, который при pH < 3,1 имеет красную окраску, а при pH > 4,4 окрашивается в желтый цвет. В интервале значений pH 3,1 ¸ 4,4 окраска индикатора становится оранжевой.
Титрование воды раствором HCl сопровождается протеканием реакции нейтрализации
OH ¯ + H + → H 2 O, (6)
в которой ионы H + диссоциирующей кислоты нейтрализуют гидроксид-ионы OH ‾ , образующиеся в результате гидролиза анионов HCO 3 ‾ в воде
HCO 3 ¯ + H 2 O ↔ H 2 CO 3 + OH ¯ . (7)
Из уравнения (7) следует, что количество нейтрализующихся ионов OH¯ эквивалентно концентрации иона HCO 3 ¯.
МЕТОДЫ ОЧИСТКИ ВОДЫ
Природная вода обычно не используется без предварительной очистки. Качество воды, предназначенной для промышленных целей, улучшается в результате водоподготовки . На начальной стадии водоподготовки вода, прежде всего, освобождается от грубодисперсных и коллоидных примесей. Взвешенные и коллоидные примеси удаляются коагуляцией с последующим отстаиванием и фильтрацией. В систему водоподготовки входят умягчение (частичное или полное устранение карбонатной жесткости) и обессоливание (полное удаление из воды всех солей). Для умягчения и обессоливания воды применяются: физические (кипячение, дистилляция, вымораживание, электродиализ, магнитно-ионизационный метод, магнитная обработка, ультразвуковая обработка ), физико-химические (ионный обмен ) и химические (осаждение нерастворимых соединений ) методы очистки.
1. Карбонатная жесткость устраняется кипячением воды, определяющим существо термического метода . При этом гидрокарбонаты переходят в нерастворимые карбонаты по реакциям (5), (5а) и
Mg 2+ + 2HCO 3 ¯ + 2OH ¯ = (MgOH) 2 СО 3 ↓ + Н 2 О + CO 2 . (8)
Образующиеся осадки удаляются фильтрованием.
Для уменьшения карбонатной жесткости также применяется метод осаждения , при котором в обработанную воду вводят известь (известкование – известковый способ ):
Ca(HCO 3) 2 + Ca(OH) 2 = 2CaCO 3 ↓ + 2H 2 O, (9)
Mg(HCO 3) 2 + 2Ca(OH) 2 = Mg(OH) 2 ↓ + 2CaCO 3 ↓ + 2H 2 O. (10)
2. Устранение карбонатной Ж К и некарбонатной Ж НК жесткости осуществляется также методом осаждения, т.е. действием на воду едким натром (натронный способ ):
Ca(HCO 3) 2 + 4NaOH = CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O, (11)
Mg(HCO 3) 2 + 2NaOH = Mg(OH) 2 ↓ +2Na 2 CO 3 + 2H 2 O, (12)
действием кальцинированной содой (содовый способ ):
CaCl 2 + Na 2 CO 3 = CaCO 3 ↓ + 2NaCl, (13)
MgSO 4 + Na 2 CO 3 = CaCO 3 ↓ + Na 2 SO 4 , (14)
а также действием фосфатом натрия Na 3 PO 4 (фосфатный способ ):
3Ca(HCO 3) 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 ↓ + 6NaНCО 3 , (15)
3MgSO 4 + 2Na 3 РO 4 = Mg 3 (PO 4) 2 ↓ + 3Na 2 SO 4 , (16)
3CaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 ↓ + 6NaCl. (17)
С помощью применения известкового и содового способов умягчения (обычно они используются вместе) жесткость воды понижается до 0,3 ммоль экв/л, а фосфатного – до 0,03 ммоль экв/л.
3. Очень эффективным является метод устранения жесткости воды путём ионного обмена, который получил широкое распространение в технике. Он основан на способности некоторых природных и искусственных высокомолекулярных соединений – ионитов – обменивать входящие в их состав радикалы на ионы, которые находятся в растворе. Такой способностью обладают некоторые природные и синтетические соединения (алюмосиликаты), например натриевый алюмосиликат (Na 2 OּAl 2 O 3 ּ2SiO 2 ּnН 2 О), а также синтетические органические ионообменники (ионообменные смолы) в виде выпускаемых химической промышленностью гранул, зернистых порошков, поропластов, волокон, тканей, мембран. Они содержат подвижные функциональные группы, например сульфо- (-SO 2 OH), карбоксо- (-COOH), гидроксо- (-ОН) группы.
Иониты, сорбирующие катионы, называются катионитами , а сорбирующие анионы – анионитами . В качестве катионитов в основном применяются Na + -катиониты (алюмосиликаты: цеолит, глауконит, пермутит) и Н + -катиониты (синтетические смолы и сульфированный уголь). К используемым анионитам относятся ОН¯-аниониты на основе карбамидных смол.
При пропускании воды через слой катионита катионы Ca 2+ и Mg 2+ обмениваются на катионы Na + в соответствии с уравнением, определяющим равновесие катионного обмена:
R 2- Na 2 + ТВ + Са 2+ ВОДН « R 2- Са 2+ ТВ + 2Na + ВОДН, (18а)
где R 2- является отрицательно заряженной частицей катионита, например в случае натриевого алюмосиликата R 2- = 2- .
Для удаления из воды не только катионов Ca 2+ и Mg 2+ , но и других катионов и анионов ее пропускают через катионит, содержащий в обменной форме водородные ионы (H + -катионит) и анионит, содержащий гидроксид-ионы (OH¯-анионит). Равновесия катионного и анионного обмена для этих случаев можно записать в виде:
R ¯ H + ТВ + Kt + ВОДН « RKt + ТВ + H + ВОДН, (18б)
R + OH ¯ ТВ + An ¯ ВОДН « R + An ¯ ТВ + OH ¯ ВОДН, (18в)
где Kt + и An ¯ соответственно катионы и анионы, подлежащие удалению из воды. В данном случае катионит находится в форме H + -катионита и в раствор переходит ион водорода, а анионит – в OH ¯ -форме и в результате ионного обмена в воду поступают гидроксид-ионы. В итоге, если очищаемую воду пропустить последовательно через катионит и анионит, то она освободится как от катионов, так и анионов солей. Такая обработка воды называется обессоливанием.
Когда процесс ионного обмена доходит до равновесия, ионит перестаёт работать – утрачивает способность умягчать воду. Для возобновления работоспособности ионита его подвергают регенерации. Для этого через катионит пропускают раствор NaCl или Na 2 SO 4 (для Na + -катионита), а в случае H + -катионита – раствор HCl или H 2 SO 4 . При этом ионы Ca 2+ и Mg 2+ переходят в раствор, а катионит вновь насыщается ионами Na + и H + . Для регенерации анионита его обрабатывают раствором щёлочи. В результате поглощенные анионы вытесняются в раствор, а анионы вновь насыщаются ионами OH ¯ .
Катионитный метод умягчения воды снижает ее карбонатную жесткость до 0,01 - 0,05 ммоль экв/л.
4. Метод электродиализа основан на явлении направленного движения ионов электролита к электродам, подключенным к источнику постоянного тока, через пористые мембраны, которые расположены перед электродами на пути движения ионов. Мембраны, расположенные возле катода, содержат катионит, а возле анода - анионит. Ионы электролита обмениваются с ионами ионообменников, разряжаемых на поверхности соответствующих электродов. Таким образом, ионы металлов, обусловливающие жесткость воды, задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
5. Магнитно-ионизационный метод так же, как и метод электродиализа, использует явление направленного движения ионов, но уже под действием магнитного поля.
6. Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворённых веществ и их объединение в более крупные частицы, которые выпадают в осадок.
7. Ультразвуковая обработка воды так же, как и магнитная, приводит к образованию более крупных частиц растворенных веществ с образованием осадка.
Для определения жесткости воды необходимо сделать её анализ и затем рассчитать жесткость в единицах ГОСТ, используя закон эквивалентов.
Пример 1. Вычислить жесткость воды, зная, что в 500 л её содержится 202,5 г Ca(HCO 3) 2 .
Решение. В 1 л воды содержится 202,5:500 = 0,405 г Ca(HCO 3) 2 . Эквивалентная масса Ca(HCO 3) 2 равна 162:2 = 81 г/моль. Следовательно, 0,405 г составляют 0,405:81 = 0,005 эквивалентных масс или 5 ммоль экв/л.
Пример 2. Сколько граммов CaSO 4 содержится в одном кубометре воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль экв/л?
Решение. Молярная масса CaSO 4 – 136,14 г/моль, эквивалентная масса – 136,14: 2 = 68,04 г/моль. В 1 м 3 воды с жесткостью 4 ммоль экв/л содержится 4∙1000 = 4000 ммоль экв или 4000∙68,07 = = 272280 мг = 272,28 г CaSO 4 .
Пример 3. Сколько граммов соды надо добавить к 500 л воды, чтобы устранить её жесткость, равную 5 ммоль экв/л?
Решение. В 500 л воды содержится 500 · 5 = 2500 ммоль экв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500∙53 = 132500 мг = 132,5 г соды (53 г/моль – эквивалентная масса Na 2 CO 3).
Пример 4. Какое количество (в мл) раствора ЭДТА 0,1н необходимо для титрования воды с Ж ОБЩ = 6 ммоль экв /л?
Решение. Из закона эквивалентов следует, что для титрования требуется V 2 = (Ж ОБЩ ∙V 1)/(N 2 ∙1000) = 6500/(0,1∙1000) = 30 мл ЭДТА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Определение общей жесткости водопроводной воды
Отмерить мерным цилиндром 50 мл водопроводной воды (из-под крана) и перелить её в колбу емкостью 250 мл, добавить 5 мл аммиачно-буферного раствора и индикатор – эриохром черный Т – до появления розовой окраски (несколько капель или несколько кристаллов). Заполнить бюретку раствором ЭДТА 0,04 н (синонимы – трилон Б, комплексон III) до нулевой отметки.
Приготовленную пробу медленно при постоянном перемешивании оттитровать раствором комплексона III до перехода розовой окраски в голубую. Результат титрования записать. Повторить титрование ещё один раз.
Если разница результатов титрований превышает 0,1 мл, то оттитровать пробу воды третий раз. Определить средний объем комплексона III (V К, СР)
израсходованного на титрование воды, и по нему рассчитать общую жесткость воды.
Ж ОБЩ = , (20) где V 1 – объём анализируемой воды, мл; V К,СР – средний объём раствора комплексона III, мл; N К – нормальная концентрация раствора комплексона III, моль/л; 1000 – коэффициент перевода моль/л в ммоль/л.
Определить класс жесткости водопроводной воды.
Опыт 2. Умягчение воды методом катионирования и определение общей жесткости умягченной воды
Очистить водопроводную воду от примесей, пропустив её через колонку, заполненную катионитом. Умягченную воду собрать в стакан (можно пользоваться заранее приготовленной умягченной водой, собранной в колбу).
Определить общую жесткость 100 мл умягченной воды Ж К ОБЩ по методике опыта 1 и класс жесткости умягченной воды.
Результаты опыта записать в таблицу:
Записать уравнения процессов, протекающих при катионировании, для случаев:
а) H + -катионита;
б) Na + -катионита.
Опыт 3. Определение карбонатной и некарбонатной жесткости воды
Отобрать мерным цилиндром 50 мл водопроводной воды и перелить её в коническую колбу. Добавить к исследуемой воде несколько капель метилового оранжевого до появления желтой окраски, которая должна соответствовать или быть очень близкой к окраске контрольного раствора с этикеткой «до титрования». Заполнить бюретку раствором соляной кислоты 0,1 н до нулевой отметки.
Оттитровать приготовленную пробу раствором соляной кислоты. Оттитрованная проба должна иметь оранжевую, но не розовую окраску индикатора, и соответствовать или быть очень близкой к окраске контрольного раствора с этикеткой «после титрования».
Результат титрования записать. Повторить титрование ещё один раз. Если результаты двух титрований совпадут (различие не должно превышать 0,1 мл), рассчитать карбонатную жесткость воды. В противном случае оттитровать ещё одну пробу воды. Определить среднее значение объема раствора соляной кислоты, израсходованной на титрование воды. Рассчитать карбонатную жесткость Ж К воды в единицах ммоль экв/л, используя закон эквивалентов:
где V 1 – объём пробы анализируемой воды, мл; V К,СР – средний объём раствора HCl, израсходованного на титрование, мл; 1000 – коэффициент перевода моль экв/л в ммоль экв/л; N К – нормальность раствора HCl.
Определить некарбонатную жесткость:
Ж НК = Ж ОБЩ – Ж К. (22)
Результаты опыта записать в таблицу:
Определить класс жесткости воды по карбонатной и некарбонатной жесткости.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие катионы называются ионами жесткости?
2. Какой технологический показатель качества воды называют жесткостью?
3. Почему жесткую воду нельзя применять для регенерации пара на тепловых и атомных электростанциях?
4. Какой метод умягчения называют термическим? Какие химические реакции протекают при умягчении воды этим методом?
5. Как осуществляют умягчения воды методом осаждения? Какие реагенты используют? Какие реакции протекают?
6. Можно ли умягчать воду с помощью ионного обмена?
7. Какой процесс следует проводить для умягчения воды: катионирования или анионирования? Почему? Составить уравнения реакций, протекающих при умягчении воды с помощью ионного обмена.
8. Как определяют общую жёсткость воды?
9. Как находят некарбонатную жесткость воды?
10. Путём анализа было установлено, что в одном литре исследуемой воды содержится 42 мг ионов магния и 112 мг ионов кальция. Вычислить общую жесткость воды.
11. Сколько граммов соды надо прибавить к 10 л воды, чтобы устранить её общую жесткость, равную 4,64 ммоль экв/л?
12. Вычислить карбонатную жесткость, если на титрование 200 мл воды израсходовано 8 мл 0,05 н раствора соляной кислоты.
13. Жесткость воды обусловливается только гидрокарбонатом кальция. При кипячении 200 мл воды в осадок выпало 3 мг карбоната кальция. Чему равна жесткость воды?
14. Сколько граммов гашеной извести Са(ОН) 2 надо добавить к 1 м 3 воды, чтобы устранить ее временную жесткость, равную 2,5 ммоль экв/л?
15. Какое количество негашеной извести СаО требуется добавить к 100 л воды, содержащей 36,45 мг экв/л ионов Mg 2+ для снижения уровня их содержания в четыре раза?
16. Какое количество гидроксида кальция необходимо для снижения уровня содержания ионов Ca 2+ c 20,04 мг экв/л до 5,01 мг экв/л в воде, объем которой равен 10 м 3 ?
17. Сколько граммов фосфата натрия необходимо для снижения уровня карбонатной жесткости до 0,05 мг экв/л в 1м 3 воды, если концентрация первоначально содержащихся бикарбонат-ионов НСО 3 ¯ в воде составляла 2,5 мг экв/л?
Библиографический список
1. Коровин Н.В. Общая химия. М.: Высшая школа, 2002.
2. Глинка Н.Л. Общая химия. М.: Интеграл-пресс, 2002.
3. Суворов А.В., Никольский А.Б. Общая химия. СПб.: Химия, 2002.
4. Угай А.Я. Общая и неорганическая химия. М.: Высшая школа, 2000.
5. Соколов Р.С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. М.: Гуманит. центр ВЛАДОС, 2003. Т. 1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ.
6. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии: Учеб. пособие для техн. направ. и спец. вузов. М.: Высшая школа, 2001.
7. Хомченко Г.П. Практикум по общей и неорганической химии с применением полумикрометода. М.: Высшая школа, 1980.
Приложение
Основы метода титрования и техника эксперимента
Титрованием называется количественное определение вещества титриметрическим методом путем медленного приливания к раствору исследуемого продукта раствора реагента с точно измеренной концентрацией в количестве, которое соответствует содержанию определяемого вещества в строго эквивалентных количествах. Раствор реагента с точно измеренной концентрацией называется стандартным или титрованным , а также титрантом . Титрование проводят до тех пор, пока
|
|
не будет достигнута точка эквивалентности , в которой количество титранта становится теоретически строго эквивалентным количеству определяемого вещества в соответствии с уравнением химической реакции. Точка эквивалентности может быть установлена различными способами, например визуально по изменению окраски индикатора, который добавляют к титруемому раствору.
Для точного определения объемов растворов при проведении титрования используют мерную химическую посуду (рис. 1). Пипетки служат для отмеривания и переноса небольших объемов жидкостей. Они представляют собой длинные стеклянные трубки, расширенные в средней части (рис.1, а). Нижний конец пипетки оттянут, а в верхней ее части нанесена метка, до которой следует набирать жидкость. На расширенной части пипетки указана ее емкость, выраженная в миллилитрах. Используются также измерительные пипетки небольшой емкости, не имеющие расширения (рис. 1, б), градуированные на 0,1-1 мл.
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
а б в г д
Рис. 1. Мерная посуда для титрования:
а, б – пипетки; в, г, д – бюретки
Для заполнения пипетки ее берут за верхнюю часть большим и средним пальцами правой руки и погружают нижний конец в раствор до дна сосуда. Придерживая левой рукой сосуд с раствором, всасывают жидкость в пипетку ртом (кроме легколетучих и ядовитых жидкостей ) или с помощью резиновой груши так, чтобы уровень в ней стал на 2-3 см выше метки. Затем быстро закрывают верхнее отверстие пипетки указательным пальцем. Избыток жидкости медленно сливают до метки, ослабив нажим указательного пальца. После этого палец снова прижимают к отверстию и переносят пипетку в другой сосуд, отнимают палец от отверстия, давая жидкости стечь по стенкам сосуда.
Бюретки, представляющие собой узкие градуированные цилиндрические стеклянные трубки (рис 1, в-д), предназначены для точного измерения объема жидкостей. Нижний конец бюретки сужен и снабжен притертым краном (рис. 1, в), или соединен с резиновой трубкой, которая зажимается снаружи металлическим зажимом. Применяются также бюретки с резиновыми трубками, которые закрываются изнутри стеклянным шариком (рис. 1, д). Отсчет объемов раствора проводится с помощью нанесенных на бюретки делений и цифр. В верхней части бюреток находится нулевое деление.
В исходном состоянии уровень жидкости в бюретке, закрепленной в штативе строго вертикально, должен быть установлен на нулевом делении. Для этого в бюретку через воронку наливают жидкость на 2-3 см выше нулевого деления. Затем снимают воронку и сливают избыток жидкости. Уровень прозрачных растворов устанавливают по нижнему краю мениска.
1) Для избавления от временной жёсткости необходимо просто вскипятить воду. При кипячении воды гидрокарбонаты разлагаются с образованием осадка среднего или основного карбоната:
Ca(HCO 3) 2 = СаСО 3 ↓+ СО 2 + Н 2 О,
Mg(HCO 3) 2 = Мg 2 (ОН) 2 СО 3 ↓ +3СО 2 + Н 2 О,
и жёсткость воды снижается. Поэтому гидрокарбонатную жёсткость называют временной.
С ионами железа реакция протекает сложнее из-за того, что FeCO 3 неустойчивое в воде вещество. В присутствии кислорода конечным продуктом цепочки реакций оказывается Fe(OH) 3 , представляющий собой темно-рыжий осадок. Поэтому, чем больше в воде железа, тем сильнее окраска у накипи, которая осаждается на стенках и дне сосуда при кипячении.
2) Умягчить жёсткую воду можно и обработкой воды различными химическими веществами. Так, временную (карбонатную) жёсткость можно устранить добавлением гашеной извести:
Са 2+ +2НСО – 3 + Са 2+ + 2ОН – = 2СаСО 3 ↓+ 2Н 2 О
Mg 2+ +2НСО – 3 + Са 2+ + 4ОН – = Mg(ОН) 2 ↓+2СаСО 3 ↓+ 2Н 2 О.
При одновременном добавление извести и соды можно избавиться от карбонатной и некарбонатной жёсткости (известково-содовый способ). Карбонатная жёсткость при этом устраняется известью (см. выше), а некарбонатная – содой:
Са 2+ + СО 2- 3 = СаСО 3 ↓
Mg 2+ + СО 2- 3 = Mg СО 3
Mg СО 3 + Са 2+ + 2ОН – = Mg(ОН) 2 ↓+СаСО 3 ↓
3) Вообще, с постоянной жёсткостью бороться труднее. Кипячение воды в данном случае не приводит к снижению её жёсткости.
Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лёд превратить обратно в воду. Все соли, которые образую жёсткость, остаются в не замершей воде.
4) Ещё один способ борьбы с постоянной жёсткостью – перегонка, т.е. испарение воды с последующей её конденсацией. Так как соли относятся к нелетучим соединениям, то они остаются, а вода испаряется.
Также, чтобы избавиться от постоянной жёсткости, можно, например, к воде добавить соду:
5) Также известны методы обработки воды (магнитное и электромагнитное воздействие, добавление полифосфатов или других “антинакипинов”), позволяющие на время “связать” соли жёсткости, не давая им в течение какого-то времени выпасть в виде накипи. Однако эти методы не нейтрализуют соли жёсткости химически и поэтому нашли ограниченное применение в водоподготовке технической воды. Единственным же экономически оправданным методом удаления из воды солей жёсткости является применение ионообменных смол. Пропуская воду через слой специального реагента – ионообменной смолы (ионита), ионы кальция, магния или железа переходят в состав смолы, а из смолы в раствор переходят ионы Н + или Na + , и вода умягчается, её жёсткость снижается.
6) Но такие методы, как замораживание и перегонка, пригодны только для смягчения небольшого количества воды. Промышленность имеет дело с тоннами. Поэтому для устранения жёсткости в данном случае принимается современный метод устранения – катионный . Этот способ основан на применении специальных реагентов – катионитов, которые загружаются в фильтры и при пропускании через них воды, заменяют катионы кальция и магния на катион натрия. Катиониты – синтетические ионообменные смолы и алюмосиликаты.
Их состав условно можно выразить общей формулой Na 2 R. Если пропускать воду через катиониты, то ионы Nа + будут обмениваться на ионы Са 2+ и Mg 2+ .
Схематически эти процессы можно выразить уравнением:
Ca 2+ + Na 2 R = 2Na + + CaR
Таким образом, ионы кальция и магния переходят из раствора в катионит, а ионы натрия – из катионита в раствор, жёсткость при этом устраняется.
Катиониты обычно регенерируют – выдерживают в растворе NaCl, при участии которого происходит обратный процесс:
CaR + 2Na + = Na 2 R+ Ca 2+
Регенерированный катионит снова может быть использован для умягчения новых порций жесткой воды.
7) С последствием жёсткости воды – накипью, с точки зрения химии, можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной. Последняя и занимает место угольной, которая, будучи неустойчивой, разлагается на воду и углекислый газ. В состав накипи могут входить и силикаты, и сульфаты, и фосфаты. Но если разрушить карбонатный “скелет”, то и эти соединения не удержатся на поверхности.
8) Эффективным способом борьбы с высокой жёсткостью считается применение автоматических фильтров-умягчителей. В основе их работы лежит ионообменный процесс, при котором растворенные в воде “жёсткие” соли заменяются на “мягкие”, которые не образуют твердых отложений.
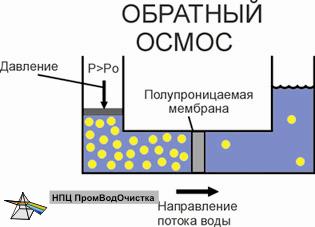
Осмос

Цепочки превращений
1. Карбонат кальция оксид кальциягидроксид кальциякарбонат кальциянитрат кальция.
2. Магний сульфат магниянитрат магнияоксид магнияацетат магния.
3. Хлорид кальция сульфат кальциясульфид кальциясульфат кальциягидроксид кальцияоксид кальциягидрокарбонат кальция.
4. Магний оксид магниягидроксид магнияхлорид магниягидроксокарбонат магниясульфат магниягидроксид магния.
5. Сульфид магния оксид магния…гидроксид магния…нитрат магния.
6. Кальций гидроксид кальциякарбонат кальцияоксид кальциякарбид кальциягидроксид кальциягидрокарбонат кальция.
Расчетные задачи
У р о в е н ь А
1. При взаимодействии 13,7 г металла с водой выделяется 2,24 л газа (н. у.). Определите металл. Какой осадок и в каком количестве образуется, если к полученному раствору прибавить избыток сульфата натрия?
Решение
Газ (H 2) выделяется при взаимодействии M Ia и IIa подгрупп с водой.
По закону эквивалентов:
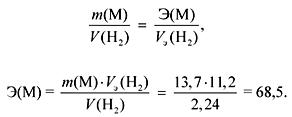
Если М Ia подгруппы, то
A r (M) = Э валентность = 68,5 (нет такого металла).
Если М IIa подгруппы, то
A r (M) = Э валентность = 137 (Ba).
Ba + 2H 2 O = Ba(OH) 2 + H 2 ,
Ba(OH) 2 + Na 2 SO 4 = BaSO 4 + 2NaOH,
(BaSO 4) = (Ba(OH) 2) = (Ba) == 0,1моль,
m (BaSO 4) = M = 0,1 233 = 23,3 г.
Ответ . Металл – Ba; m (BaSO 4) = 23,3 г.
2. Какой объем 0,5М раствора гидроксида кальция необходимо добавить к 81 г 10%-го раствора (плотность 1 г/см 3) гидрокарбоната кальция для полноты образования осадка? Определите массу осадка.
Ответ . 100 мл Ca(OH) 2 , 10 г СaCO 3 .
3. На раствор, содержащий 23,3 г смеси сульфата и хромата калия, подействовали избытком хлорида бария. Осадок отфильтровали, промыли, а затем к нему добавили избыток соляной кислоты. Часть осадка растворилась, оставшуюся часть отфильтровали, промыли и просушили. Масса осадка после просушивания составила 23,3 г. Определите состав исходной смеси.
Ответ . 17,4 г K 2 SO 4 и 5,9 г K 2 CrO 4 .
4. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 1:3:4 (в порядке перечисления). Какой объем воды может вступить в химическое взаимодействие с 35 г такой смеси?
Ответ . 17,568 мл.
5. Растворимость гидроксида стронция в воде при 100 °С равна 28 г, а при 25 °С – 1 г на 100 г воды. 200 г раствора гидроксида стронция, насыщенного при 100 °С, охладили до 25 °С. Найдите массу октагидрата гидроксида стронция, выпавшего в осадок при охлаждении раствора.
Ответ . 93,08 г Sr(OH) 2 8H 2 O.
У р о в е н ь Б
1. Некоторую массу кристаллогидрата карбоната магния прокаливали до прекращения выделения газов. Последние были пропущены через промывные склянки с концентрированной серной кислотой и известковой водой. Масса первой склянки увеличилась на 1,8 г, а во второй выпало 2 г осадка. Определите состав исходного кристаллогидрата и его массу.
Ответ . Пентагидрат MgCO 3 5H 2 O; 3,48 г.
2. Молярное соотношение карбоната, гидрокарбоната и нитрата кальция в смеси массой 100 г равно 1:2:3 (в порядке перечисления). Какой объем при 1200 °С и нормальном давлении займут газообразные продукты разложения этой смеси?
Решение
Уравнения реакций разложения компонентов смеси:
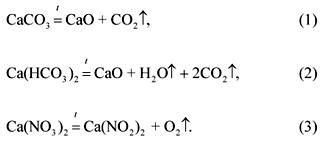
По условию задачи:
(CaCO 3) : (Ca(HCO 3) 2) : (Ca(NO 3) 2) = 1: 2: 3.
Пусть (CaCO 3) = x моль.
Тогда (Ca(HCO 3) 2) = 2x ;
(Ca(NO 3) 2) = 3x ;
100х + 162 2х + 164 3х = 100,
х 0,109 моль.
При р = 101,3 кПа и t = 1200 °C в газообразном состоянии выделяется:
СО 2 по уравнению (1):
1 (CO 2) = (CaCO 3) = x = 0,109 моль;
H 2 O, СО 2 по уравнению (2):
2 (H 2 O) = (Ca(HCO 3) 2) = 2x = 0,218 моль,
2 (CO 2) = 2(Ca(HCO 3) 2) = 4x = 0,436 моль;
О 2 по уравнению (3):
3 (O 2) = (Ca(NO 3) 2) = 3x = 0,327 моль.
Суммарное количество молей газообразных продуктов разложения:
0,109 + 0,218 + 0,436 + 0,327 = 1,09 моль (н.у.).
Из уравнения состояния идеальных газов находим объем:
pV = RT ,
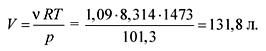
Ответ . V = 131,8 л.
3. Смесь равных количеств гидроксида и карбоната двухвалентного металла прокалили. Масса твердого остатка оказалась меньше массы исходной смеси в 1,775 раза. К этому остатку добавили в 10 раз большую массу 5%-го раствора серной кислоты. Рассчитайте массовые доли веществ в образовавшемся растворе.
Ответ . 6% MgSO 4 .
4. При обработке водой смеси гидрида и нитрида двухвалентного металла с равными массовыми долями образовалась газовая смесь с плотностью по водороду 2,658. Установите металл, входящий в состав соединений (при расчетах цифры не округлять!).
Ответ . Кальций.
5. Магниевую пластинку массой 16 г опустили в 16%-й раствор сульфата меди(II) массой 350 г. Когда пластинку извлекли, массовые доли содержащихся в растворе солей оказались одинаковыми. Во сколько раз увеличилась масса пластинки?
Ответ. В 4,5 раза.
Качественные задачи
1. С какими из данных веществ будет взаимодействовать гидроксид магния: соляная кислота, азотная кислота, углекислый газ, хлорид натрия, гидроксид бария, серная кислота, оксид меди(II)?
Ответ . HCl, HNO 3 , H 2 SO 4 .
2. В склянках без этикеток находятся сода, мел, гипс и сульфат натрия. Как с помощью воды и азотной кислоты можно распознать эти вещества?
Ответ .
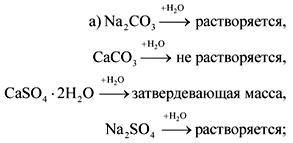
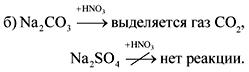
3. Вещество А – легкий, довольно твердый серебристо-белый металл. При взаимодействии вещества А с В, являющимся простым газообразным веществом, образуется соединение С, растворимое в воде с образованием щелочного раствора. При обработке вещества С серной кислотой образуется соль, кристаллогидрат которой применяется в медицине для наложения фиксирующих повязок при переломах. Приведите уравнения реакций.
Ответ . А – Ca; B – H 2 ; С – CaH 2 ; кристаллогидрат – CaSO 4 2H 2 O.
4. Вещество А – оксид, растворимый в воде с образованием щелочного раствора. Соединение В, находящееся в таком растворе, реагирует с газом С, не имеющим запаха, с образованием белого осадка, который постепенно растворяется по мере дальнейшего пропускания газа С. Приведите уравнения реакций, идентифицируйте вещества.
Ответ . А – CaO, BaO; B – Ca(OH) 2 , Ba(OH) 2 ; С – CO 2 .
5. Вещество А, входящее в состав одного из самых распространенных в земной коре минералов, разлагается при высокой температуре на два оксида, один из которых В всегда образуется в процессе жизнедеятельности. При взаимодействии вещества В с графитом при нагревании получается токсичный для теплокровных животных газ С, без цвета и запаха, горючий. Приведите уравнения реакций, идентифицируйте вещества.
Ответ . А – CaСO 3 ; B – CO 2 ; С – CO.
Cтраница 1
Устранение временной жесткости проводится кипячением воды. При кипячении гидрокарбонаты разрушаются, образующиеся малорастворимые карбонаты выпадают в осадок. При введении в воду карбоната натрия, гидроксида кальция удаляется общая жесткость воды. Карбонатная жесткость при этом устраняется известью, а некарбонатная - содой.
Кроме устранения временной жесткости, известь осаждает из воды весь магний, железо и способствует коагуляции органических и неорганических коллоидов.
После очистки примесей, устранения временной жесткости и деаэрации подпиточную воду подают в теплообменник (2), где она подогревается до 335 К. Подпиточную и обратную воду после смешения подают насосом во вторую зону теплообменника (2), где она подогревается до 355 К и поступает в тепловые сети.
Умягчение часто применяется для устранения временной жесткости воды, предназначенной для восполнения потерь (подпитки) в замкнутых системах оборотного водоснабжения и недопущения минерального обрастания теплообменных и охлаждающих поверхностей, контактирующих с оборотной водой. Во многих случаях подпиточная вода является основным источником накопления в оборотной воде ионов кальция и биокарбонатов, которые в системах с высокими коэффициентами упаривания могут нарушать стабильный состав оборотной воды.
Умягчение воды с целью устранения временной жесткости проводится химическим способом путем ввода реагентов, в качестве которых применяются известь, серная или соляная кислоты. Химическими методами достигается относительно неглубокое умягчение воды. Для более высокой степени умягчения применяют катионитовые методы, сущность которых заключается в использовании способности некоторых веществ обменивать катионы содержащегося в них натрия на катионы солей жесткости, находящихся в воде.
Сода каустическая используется на тепловых электростанциях для устранения временной жесткости воды, для регенерации аниови-товых фильтров, применяемых на установках химического обессоли-вания воды.
Сода каустическая используется на тепловых электростанциях для устранения временной жесткости воды, для регенерации аниони-товнх фильтров, применяемых на установках химического обес поливания воды.
Аналогичным образом следует рассчитывать также и количество Са (ОН) 2, необходимое для устранения временной жесткости.
Почему для устранения временной жесткости, обусловленной солями магния, требуется большее количество извести, чем для устранения временной жесткости, обусловленной солями кальция.
Поэтому для подпитки замкнутых (беспродувочных) систем водоснабжения следует осуществлять сравнительно глубокое умягчение подпиточной воды и устранение временной жесткости.
Введение небольших количеств щелочных реагентов повышает эффективность магнитной обработки воды, хотя само по себе введение щелочных реагентов, например, извести в количествах не более 10 - - 20 % от необходимых для устранения временной жесткости согласно исследованиям, выполненным в ХИЭИ в 1959 г., уменьшает накипеобразование в 8 - 10 раз.
При этом шест-кость воды, обусловленная бикарбонатами, устраняется. Поэтому такая жесткость называется временной, или бикарбонатной. Следовательно, для устранения временной жесткости достаточно прокипятить воду.
Соли постоянной жесткости, например СаСЬ, CaSO4 и др., при нагревании из воды не удаляются. Они выделяются в осадок при испарении воды, образуя на стенках аппаратов трудно удаляемую плотную накипь. Жесткую воду можно использовать только в тех случаях, когда условия ее применения не вызывают выделения твердых осадков, например в холодильниках, где охлаждающая вода не нагревается до температуры, способствующей устранению временной жесткости. В котельных установках, где вода не только нагревается, но и испаряется, недопустима не только временная, но и постоянная жесткость. Поэтому воду для них предварительно очищают от солей кальция и магния химическим способом на специальных установках.
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа № 1
с углубленным изучением отдельных предметов
Адрес: Белгородская область,
Исследование жесткости воды
и способов ее устранения
ученица 11 «А» класса МОУ «Средняя
общеобразовательная школа № 1
с углубленным изучением
отдельных предметов
Адрес: Белгородская область,
Научный руководитель: ,
учитель химии МОУ «Средняя
общеобразовательная школа № 1
с углубленным изучением
отдельных предметов
г. Нового Оскола Белгородской области»
Адрес: Белгородская область,
г. Новый Оскол,
г. Новый Оскол
1. Введение ………………………………………………………………….3
2. Жесткость воды и способы ее устранения…………………………….4
· Почему вода становится жесткой………………………………………4
· Значение жесткости воды в жизни человека…………………………..4
· Способы устранения жесткости………………………………………...5
3. Исследование жесткости воды и способов ее устранения…………...8
4. Заключение и выводы
5. Список использованной литературы
Введение
Кто учился наукам, но не применяет их,
похож на того, кто пахал, но не сеет.
Саади
В 80-х годах 20 века в нашей стране появились книги Пола Чаппиуса Брэгга, посвященные пропаганде здорового образа жизни. И хотя многие ученые считают его мнение спорным, книги Пола Брэгга заслуживают внимания. Один из разделов его книги (Мои первые опыты с жесткостью) посвящен проблеме жесткости воды, где автор в своих воспоминаниях описывает болезнь своего деда, который умер от того, что его кровеносные сосуды стали окаменевшими от жесткой воды, и женщину, жившую в их краях (несчастную называли каменной женщиной, так как тело её от большого количества солей в буквальном смысле слова окаменело). Та женщина была одной из многочисленных жертв жесткой воды. Органам несчастной не удалось справиться с переработкой большого количества неорганических веществ, содержащихся в такой воде, и они стали очень активно накапливаться в ее организме.
Соединения кальция осаждаются в нашем организме в виде камней в почках и желчном пузыре.
На сегодняшний день очистка воды является не прихотью и баловством, а скорее жизненной необходимостью. Дело в том, что такие неприятные явления, как накипь, сторонние привкусы, запахи, а также наличие мутного осадка доставляют не только массу неудобств, но и являются причиной многих заболеваний. Вода низкого качества способствует отложению солей, ускоряет процесс старения организма, становится причиной перехода многих заболеваний в хроническую стадию. К тому же хлор содержит ряд веществ, способных вызывать раковые заболевания. А ведь именно вода является основой всей жизни и без воды не может обходиться ни один живой организм. К примеру, человек состоит из воды на 60-65%. Поэтому чистая вода жизненно необходима для каждого человека. К сожалению, природная вода в наше время совершенно непригодна для употребления без предварительной очистки, что подтверждают различные анализы воды. Всем известно, что фильтрационные станции, которые якобы проводят очистку воды, давно нуждаются в капитальном ремонте , а водопроводные сети, по которым вода доставляется в наши дома, требуют замены.
Целью нашей работы стало исследование уровня жесткости воды в нашем родном городе.
Жесткость воды и способы ее устранения
Почему вода становится жесткой
Кальций и его соединения очень нужны организму: ведь именно из ортофосфата кальция Са3(Р04)2 состоят кости и зубы человека и животных. Образуются они из растворимых соединений кальция, которые разносит кровь по всему организму. Благодаря катионам кальция Са2+ кровь получает возможность свертываться, образуя сгустки, закупоривая ранки и прекращая кровотечения.
Соединения кальция бывают не только полезными, но и очень вредными - например, когда они придают жесткость обычной воде. В повседневном обиходе слово «жесткость», на первый взгляд, можно применить только к твердым телам: твердой может быть скамейка в парке или табуретка на кухне. Однако жесткой бывает и вода.
Основным источником попадания в воду солей магния и кальция являются размываемые природными водами залежи известняков, гипса и доломитов..
В маломинерализованных водах больше всего ионов кальция. С увеличением степени минерализации содержание ионов кальция быстро падает и редко превышает 1 г/л. Содержание же ионов магния в минерализованных водах может достигать нескольких граммов, а в соленых водах нескольких десятков граммов.
Жёсткость воды - совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния. Вода с большим содержанием таких солей называется жёсткой, с малым содержанием - мягкой. Различают временную жёсткость (карбонатную), образованную гидрокарбонатами и постоянную жёсткость (некарбонатную), вызванную присутствием других солей. Временная жёсткость обусловлена присутствием в воде гидрокарбонатов кальция и магния (Са(НСО3)2; Мg(НСО3)2). Постоянная жесткость воды обусловлена присутствием в воде сульфатов, хлоридов Са и Мg (СаSO4,CaCl2,MgSO4,MgCl2).
Значение жесткости воды в жизни человека
Жесткостью воды называется сумма растворенных в воде ионов кальция Са2+ и магния Mg2+.
Ионы кальция и магния не приносят особого вреда живым организмам, однако наличие их в воде в большом количестве нежелательно, поскольку такая вода непригодна для хозяйственных нужд.
В жесткой воде увеличивается расход мыла и порошка при стирке белья, медленно разваривается мясо и овощи, снижается моторика желудка. Жесткая вода непригодна для систем водоснабжения и питания водонагревательной техники.
Жесткость измеряется в миллиграммах эквивалент на литр (мг-экв/л). Промышленные стандарты допустимого значения жесткости зависят от типа используемого оборудования. Обычно, считается жесткой вода с жесткостью 1 мг-экв/л и более.
Жесткость – это наиболее распространенная проблема качества воды. Первоначально термин «жесткая вода» применялся к воде, стирка в которой была затруднена.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность , которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая - незначительно увеличивает риск сердечно-сосудистых заболеваний.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Способы устранения жесткости
Различают общую жесткость, которая складывается из временной и постоянной .
Кипячение.
Временная жесткость (устранимая или карбонатная) обусловлена присутствием в воде гидрокарбонатов Са(НСО3)2 и Mg(НСО3)2. Карбонатную жесткость легко устранить кипячением воды , при котором Са2+ и Mg2+ удаляются образуя нерастворимые осадки:
Са(НСО3)2 CаСО3↓ + СО2 + Н2О
Ионы Mg осаждаются в виде основного карбоната или в виде гидроксида магния (при рН > 10,3).
2Mg2+ + ОН)2СО3↓ + СО2 + Н2О
(ионы ОН- образуются за счет взаимодействия ионов с водой: и равновесие при нагревании смещается вправо).
Для уменьшения карбонатной жесткости применяется метод известкования , при котором в обрабатываемую воду вводят известь Са(ОН)2. Реакции, протекающие при введении извести, можно записать в молекулярной форме:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + Н2О
Mg(НСО3)2 + Са(ОН)2 → Mg(ОН)2↓ + 2СаСО3 + Н2О
Постоянная жесткость (неустранимая или некарбонатная) сохраняется при кипячении воды, поскольку постоянная жесткость обусловлена присутствием в воде сульфатов, хлоридов и других солей Са и Mg. Количественно она равна концентрации ионов Са2+ и Mg2+ за вычетом временной жесткости. Для снижения карбонатной жесткости обычно используют кальцинированную соду (Na2CO3):
MgSO4 + Na2CO3 → MgCO3↓ + Na2SO4
При одновременном добавлении извести и соды можно избавиться от карбонатной и некарбонатной жесткости (известково-содовый способ ).
Вся жесткость устраняется и при введении ортофосфата натрия , тетрабората натрия и др. Поскольку ортофосфаты менее растворимы, чем карбонаты, их использование при умягчении воды более удобно:
3CaSO4 + 2Na3PO4 → Ca3(PO4)2↓ + 3Na2SO4
Современный способ умягчения воды основан на использовании ионно-обменных смол - ионитов (катионитов и анионитов). Катиониты – это синтетические ионно-обменные смолы – алюмосиликаты, например:
Их состав условно можно выразить общей формулой Na2R, где Na+ - весьма подвижный катион и R - - частица катионита, несущая отрицательный заряд.
При протекании жесткой воды через слой катионита происходит обмен катионов по реакциям:
Ca2+ + Na2R → 2Na+ + CaR
Mg2+ + + Na2R → 2Na+ + MgR
Таким образом, ионы Ca2+ и Mg2+ из раствора переходят в катионит. Для восстановления катионита его промывают концентрированным раствором NaCl:
CaR + 2NaCl → СаCl2 + Na2R
После промывки катионит можно использовать снова для удаления жесткости из воды.
Обратный осмос . Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды . В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ . Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода . Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом - до 0,01 мг-экв/л.
Лучшим реагентом для устранения общей жесткости воды является отофосфат натрия Na3PO4: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки(дистилляцией)
На сегодняшний день существуют отличные фильтры для очистки воды, которые без проблем устанавливаются в квартире и служат прекрасным средством для качественной водоподготовки. Возможно, многие сегодня предпочитают покупать в супермаркетах очищенную воду в бутылях. Выбор такой воды поистине огромен, но можно ли быть на 100% быть уверенным в её качестве? Пожалуй, нет! Именно поэтому очистка воды при помощи специально предназначенных фильтров для очистки является наиболее оптимальным решением для современного человека, заботящегося о своем здоровье и здоровье своих близких. Системы для очистки воды бывают самые разнообразные. Как правило, они отличаются: производительностью, некоторыми параметрами, степенью очистки воды, а также дизайном. Фильтры для воды прекрасно очищают воду и делают её пригодной для питья, уменьшают содержание в ней алюминия , железа, марганца, хлора, всевозможных нитратов. Кроме того, фильтры для очистки воды помогают устранить неприятный запах, привкус, а также избавиться от микробов и бактерий, содержащихся в воде. Вода, которая прошла очистку через такие системы, становится менее жесткой, однако абсолютно не теряет полезные вещества, необходимые для человеческого организма. Фильтры для воды – это отличная возможность получать очищенную воду в неограниченных количествах, не выходя из дома. Правильно подобранный фильтр станет отличным решением проблемы чистой воды, поправит здоровье и продлит ваше долголетие.
Исследование жесткости воды и способов ее устранения
Жесткость воды обусловлена наличием ионов Са2+ и Mg2+. Чем выше их содержание в природной воде (вода, прошедшая через известковые горные породы и почвы), тем больше ее жесткость.
Количественно жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в одном литре воды (мэкв/л). Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+.
Следовательно, при решении задач можно воспользоваться формулой:
(ммоль – экв/л),
где m – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг;
Мэ – эквивалентная масса этого вещества, г/моль;
V – объем воды, л.
По жесткости все природные воды делятся на мягкие (общая жесткость менее 2 ммоль/л) и жесткие со средней степенью жесткости (2-10 ммоль/л) и высокой степенью жесткости (более 10 ммоль/л).
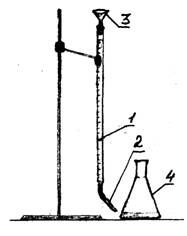
1 - бюретка
2 - пипетка
3 - воронка
Рисунок 1 – Экспериментальная установка
Выполнение опыта
В три колбы отмерить большим мерным цилиндром по 100 мл воды. В каждую колбу с водой добавить 2-3 капли индикатора метилового оранжевого. Титрование проводим 0,1 н. раствором соляной кислоты с помощью бюретки. Уровень кислоты в бюретке установить на нулевое деление. Приливать соляную кислоту по каплям до изменения окраски раствора от желтой до оранжево-розовой. Зафиксировать объем кислоты, пошедшей на титрование. Титрование повторить еще два раза. Данные занести в таблицу.
Расчет сделать по формуле:
![]() (ммоль – экв/л),
(ммоль – экв/л),
где – нормальная концентрация соляной кислоты;
Vcp (HCl ) – средний объем HCl, пошедший на титрование;
Vводы – объем воды взятой на титрование.
Полученные данные мы оформили в виде таблицы.
Образец воды
используемый для титрования
используемый для титрования отфильтрованной воды
Вода из под крана – кабинет химии
Вода из под крана – ул. Авиационная
Вода из под крана – ул. Октябрьская
Вода из колонки – п. Прибрежный
Вода из под крана – ул. Покровского
Вода из колодца – ул. Покровского
Вода из под крана – ул. Белгородская
Вода из под крана – ул. Солдатская
Вода газированная «Красиво»
В условиях школьной лаборатории нами было проведено исследование воды, взятой из разных источников, на предмет жесткости. Для определения жесткости было использовано титрование природной воды соляной кислотой в присутствии индикатора метилового оранжевого. Определялась карбонатная жесткость образца воды до и после пропускания ее через бытовой фильтр (был использован «Аквафор»).
В результате проведенной работы были сделаны следующие выводы:
1) Вода в г. Новом Осколе жесткая (Ж = 7-10,5). Многие люди проживают в частном секторе и пользуются водой из колодцев, а эта вода очень жесткая.
2) Вода, поступающая в водопровод подвергается очистке и умягчению (Ж = 6-7), поэтому может считаться средней жесткости (согласно ГОСТу, общая жесткость питьевой воды не должна быть более 7 ммоль/л).
3) Самым простым домашним способом умягчения воды традиционно остается кипячение.
4) Опыты показали, что бытовые фильтры также прекрасно умягчают воду. Так, взятая для исследования вода из колодца на ул. Покровского (жесткость 10,5 ммоль/л), после фильтрования имела жесткость всего 2 ммоль/л, что даже ниже физиологической нормы (3,5 ммоль/л). Таким образом, фильтры для воды – это отличная возможность получать очищенную воду в неограниченных количествах, не выходя из дома.
Список использованной литературы
1. , . руководство к практическим занятиям по гигиене с техникой санитарно-гигиенических исследований. – М.: «Медицина», 19с.
2. и. Основы химического анализа. Учебное пособие для учащихся. – М.: «просвещение», 1971. – 192 с.
3. . Неорганическая химия: Учеб. для технолог. спец. вузов. – М.: Высш. шк., 1989. – 432 с.
4. , . Следим за окружающей средой нашего города: 9-11 кл.: Школьный практикум. – М.: Гуманит. изд. центр ВЛАДОС, 2001. – 112 с.
5. Химия: Справ. изд./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем._ М.: Химия, 1989. – Пер. изд.: ГДР, 1986. – 648 с.




